ウイルスに対する自然免疫の研究
ウイルスに感染すると・・・
概要:
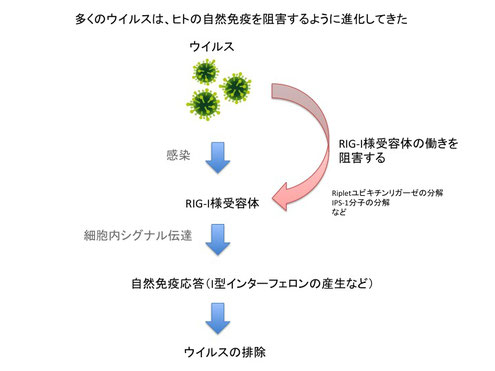
新型コロナウイルスのように飛沫感染するウイルスは、鼻や口などか入り気道や肺などの細胞にウイルスが感染し増殖します。上皮細胞、マクロファージ、樹状細胞といった細胞が自然免疫応答に関わります。これらの細胞は自然免疫応答として、強い抗ウイルス作用を持つI型インターフェロンと呼ばれるサイトカインを分泌します。このI型インターフェロンにはIFN-αとIFN-βがあります。これらのI型インターフェロンが細胞の受容体に結合すると、RNaseLなどのウイルスのRNAを分解するタンパク質や、PKRなどのウイルスタンパク質の合成を止めるタンパク質が発現されてウイルスの感染が阻止されます。このような初期の免疫応答は生まれたての赤ちゃんなどでも働くことから、ヒトが生まれながら自然に持っている免疫応答ということで、「自然免疫」と呼ばれます。
多くの場合は自然免疫によって感染は阻止されます。そのためウイルスに対する抗体もほとんどできず症状もでないため感染したことにすら気づかないことも多くあります。しかし、体調不良や、あるいは、多すぎるウイルスを取り込んだことが原因となって、自然免疫だけではウイルスを排除できなくなった場合には、「獲得免疫」が働き始めます。
獲得免疫ではT細胞とB細胞が活性化します。しかし、T細胞とB細胞は感染してから一週間ほどしてようやく活性化します。T細胞はB細胞の抗体産生を助けるだけでなく、感染した細胞に細胞死を誘導します。また、B細胞は形質細胞へと分化し抗体を分泌します。抗体には中和作用と呼ばれる働きがあり、中和作用によってウイルスはヒトの細胞に感染できなくなります。このように自然免疫と獲得免疫が適切に働くことで、ウイルスに感染してもやがて回復します。
自然免疫の重要性:
自然免疫は古くから知られている言葉です。この自然免疫で働く主な細胞の一つのマクロファージについては、ロシア人の動物学者であるイリヤ・メチニコフによって発見され、彼はノーベル賞を受賞しました。このマクロファージがどのようにウイルスを認識するのかについて2000年頃になってようやく明らかになっています。まず、アメリカのFlavell RAや、日本の瀬谷司と松本美佐子らによってToll様受容体3(TLR3)がウイルス由来の二本鎖のRNAが認識されることが発見されました。TLR3の他にも、細胞質内のウイルス由来RNAについてはRIG-IやMDA5分子によって認識されることが日本の藤田尚志と米山光俊らによって発見され、ウイルスの一本鎖RNAについてはTLR7分子によって認識されることがCaetano Reis e Sousaらによって発見されました。
実験動物としてこれらの分子を欠損したマウスを用いた実験から、TLR3, TLR7, RIG-I, MDA5などの分子を失うと感染に非常に弱くなりI型インターフェロンが産生されなかったり、感染後に一週間ほどでほとんどのマウスが死亡したりしたことから、ウイルス感染に対して自然免疫は非常に重要な役割をしていることがわかっています。
獲得免疫の重要性:
ウイルス感染では以前から抗体が非常に重要な役割をすることが知られています。特に抗体の中和作用はウイルスの感染を阻止できるため非常に重要です。ウイルスは通常細胞表面の分子に結合することで細胞と結合し細胞内へと侵入します。例えば新型コロナウイルスは、ウイルスのスパイクタンパク質がヒト細胞上のACE2分子に結合します。抗体分子はこのスパイクタンパク質とACE2分子の間に割り込むことで、ウイルスとヒト細胞との結合を阻害して感染を阻止します。抗体分子ができるためにはRAG1やRAG2分子が必要ですが、これらの分子が無いマウスでは感染に非常に弱くなることから、自然免疫に加えて獲得免疫も非常に重要な働きをすることが知られています。
自然免疫で働くTICAM-1分子によるIL-17シグナルの制御
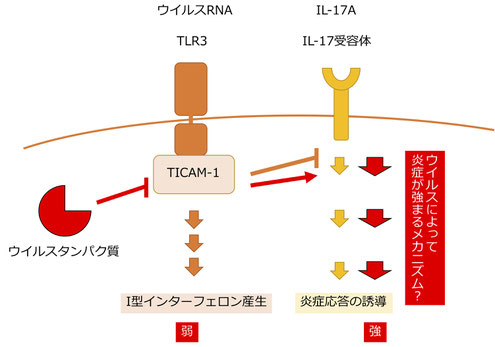
TICAM-1(別名TRIF)は、ウイルス由来のRNAを細胞のエンドソームで認識するTLR3のアダプター分子として私たちの研究室で発見した分子です。TICAM-1を欠損したマウスでは、ポリオウイルス感染時の自然免疫応答に強い欠損が生じることを私たちは発見しています。また、別のグループの研究では、このTICAM-1がC型肝炎ウイルスのNS3-4A分子によって切断されて機能を失うことや、TICAM-1遺伝子に変異があるヒトでは、新型コロナ感染時に重症化することも報告されています。
このTICAM-1分子について、私たちは炎症を誘導するIL-17と呼ばれるサイトカインのシグナル経路にも働くことを発見しました。これまでToll様受容体とサイトカイン受容体の両方で働く分子としては、MyD88分子がしられていましたが、MyD88はIL-1の受容体のシグナル経路に関与します。今回わたしたちはTICAM-1がIL-17受容体のシグナル経路にはTICAM-1が関与することを明らかにしました。そのため、ウイルスは自然免疫を抑制するためにTICAM-1を切断することがありますが、その時に同時にIL-17シグナルにも影響を与えることが考えられます。この発見は、ウイルス感染時の炎症応答や病態の理解に役立つと期待されます。(Miyashita Y et al., Life Science Alliance 2021)
自然免疫で働くRiplet分子による抗腫瘍免疫応答の制御
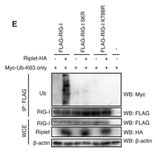
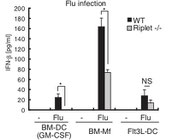
RipletはE3ユビキチンリガーゼとして私たちの研究室で発見した分子です。これまでの研究から、Riplet分子は感染細胞内でウイルス由来の二重鎖RNAを認識するRIG-Iをユビキチン化します。そのため、Ripletの遺伝子をノックアウトしたマウスでは、ウイルス感染後のI型インターフェロンの産生が大きく低下します。
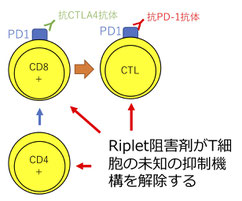
このRipletノックアウトマウスの研究をしている中で、私たちはRipletノックアウトマウスでは抗PD-1抗体などを用いががん免疫療法が非常に効果的になることを発見しました。そのメカニズムとしてRipletがT細胞の機能にも関与することを明らかにしました。今後は、このRiplet分子を標的とした薬剤が新しい抗がん剤として開発できると期待されます。(Iwamoto A et al., Journal of Immunology 2022)
RIG-I様受容体の新型コロナウイルスに対する自然免疫応答
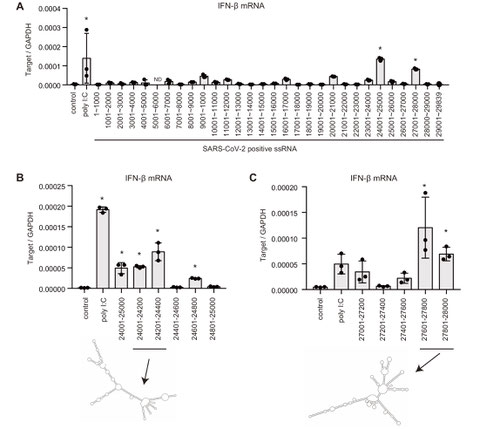
2020年にパンデミックとなった新型コロナウイルス(SARS-CoV-2)は、コロナウイルス科のウイルスです。これまでコロナウイルスに対する自然免疫の分子メカニズムは十分には解明されていませんでした。そこで、私たちはウイルスに対する自然免疫で働くRIG-I様受容体が、SARS-CoV-2に対する自然免疫でどのように働くのかについて調べました。
RIG-I様受容体は細胞質内でウイルス由来の二重鎖RNAを認識してI型インターフェロン産生を誘導する分子です。研究を進めたところ、SARS-CoV-2は細胞質内でRIG-IとMDA5の両方の分子に認識されI型インターフェロンの産生が誘導されることを発見しました。また、ウイルスのRNAゲノムの2つの領域が特殊な二次構造をとるために認識されやすいことも発見しました。
興味深いことに、SARS-CoV-2の複数のタンパク質がRIG-IやMDA5依存的なシグナル経路を抑制できることも発見しました。これはSARS-CoV-2がヒトの自然免疫を抑制することで感染を成立させることを示唆しています。(Kouwaki T et al., Frontiers in Immunology 2021)
ZNF598分子による過剰な自然免疫の抑制
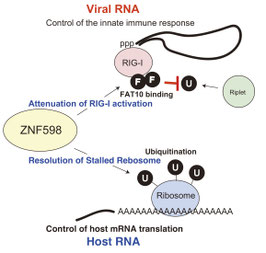
ウイルス感染初期には強い抗ウイルス作用をもつI型インターフェロンが産生されますが、I型インターフェロンそのものは自己免疫疾患の原因となることも知られています。そのためI型インターフェロンは過剰に産生されると危険です。わたしたちの自然免疫がそのような過剰なI型インターフェロン産生を誘導しないメカニズムとしてZNF598分子の働きを新たに発見しました。
ZNF598分子は、細胞質内でウイルス由来の二重鎖RNAを認識するRIG-I分子に、ユビキチン様タンパク質であるFAT10分子をRIG-Iに結合させる活性があることを発見しました。このFAT10分子がRIG-Iに結合することで、RIG-Iの活性化に必要なユビキチンがRIG-Iに結合できなくなります。そのため、RIG-I依存的なI型インターフェロンの産生が抑制されることがわかりました。(Wang G et al., Cell Reports 2019)
RIG-I様受容体とウイルス感染
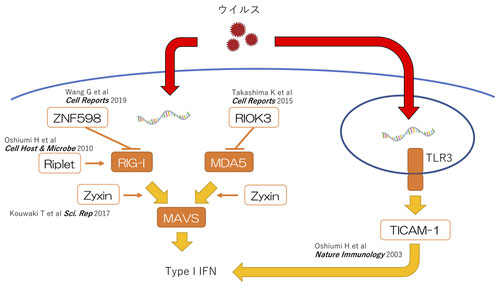
細胞内にウイルスが侵入すると、ウイルスのゲノムとなるRNAが細胞質に現れます。その時にRIG-Iタンパク質やMDA5タンパク質がウイルスのRNAと結合すると自然免疫応答としてI型インターフェロン(Type I IFN)産生が始まります。
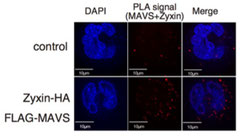
RIG-IとMDA5はそれぞれ、細胞のミトコンドリアに在るMAVSタンパク質と結合すると、MAVSタンパク質はミトコンドリア表面にプリオン様のフィラメントを形成します。このプリオン様フィラメントができるとTBK1などのリン酸化酵素が活性化し、IRF-3などの転写因子がI型インターフェロン遺伝子のプロモーターからの転写を誘導し、I型インターフェロンが産生されます。
このRIG-IとMDA5は自然免疫応答としてのI型インターフェロンの産生に非常に重要な役割を果たしますが、そのシグナル経路に関わる分子としてZyxin分子やRiplet分子などを私たちは発見しました。一方で、RIG-IとMDA5が過剰に活性化すると自己免疫疾患を発症することも知られています。そのため、これらの分子の活性経路には抑制性の分子も重要な役割を果たします。私たちはこの抑制に関わる分子としてZNF598分子やRIOK3分子を発見しました。
具体的な実験例(下記の図は当研究室で実施し論文などで発表したデータです)
C型肝炎ウイルスによる自然免疫の抑制
C型肝炎ウイルスはヒトの肝がんの約7割の原因となるウイルスです。C型肝炎ウイルス(Hepatitis C Virus: HCV)は、フラビウイルス科の一本鎖RNAをゲノムにもつウイルスです。
自然免疫応答により産生されるI型インターフェロンは、C型肝炎の治療薬としても使用されています。C型肝炎ウイルスが感染すると、自然免疫応答によりI型インターフェロンが産生され、ウイルスは排除されるはずですが、C型肝炎ウイルスは、この自然免疫応答を抑制する能力をもっています。
2005年にスイス、ローザンヌ大学のTshopp Jらは、C型肝炎ウイルスのもつタンパク質の一つが、自然免疫応答で重要なMAVS(別名Cardif又はIPS-1)と呼ばれる分子を切断することで、I型インターフェロンの産生を抑制することを報告しました(Melylan E et al Nature 2005 437:1167-1172)。一方で、私達の研究グループは2013年に、このC型肝炎ウイルスのタンパク質が、自然免疫で働く分子の一つのRiplet分子も切断することを報告しました(Oshiumi H et al PLoS Pathogens 2013 9:e1003433)。他のグループは、自然免疫で働くTICAM-1(別名TRIF)と呼ばれる分子がC型肝炎ウイルスのタンパク質により切断されることも報告されています。これらMAVS,Riplet,TICAM-1は全て、I型インターフェロンの産生で非常に重要な役割を果たす分子です。このように、C型肝炎ウイルスは、ヒトの自然免疫系の分子を分解することで、自然免疫応答から逃れ、ヒトの肝臓で十数年に亘り持続感染し、肝がんの原因となることがわかってきました。
C型肝炎ウイルスのNS3-4Aプロテアーゼは、ウイルスタンパク質の成熟のために働きますが、このウイルスのNS3-4Aプロテアーゼは、ヒトの自然免疫で働くMAVSやRiplet分子を切断します。これらの分子は、ウイルス感染時のI型インターフェロン産生に必須であるため、C型肝炎ウイルスに感染したヒトの肝細胞はI型インターフェロンを産生できません。
I型インターフェロンは強い抗ウイルス作用を持つため、C型肝炎の治療薬としても使用されています。このように、ウイルスはヒトの自然免疫を抑制する能力をもつことが多々あります。
C型肝炎ウイルス以外にも、新型インフルエンザなどで知られるA型インフルエンザウイルスのNS1タンパク質もRiplet分子の機能を抑制することが知られています。
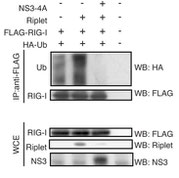
C型肝炎ウイルスのNS3-4Aタンパク質があると、RipletによるRIG-Iのユビキチン化が阻害されてしまいます。
(Oshiumi H et al PLoS Pathogens 2013)
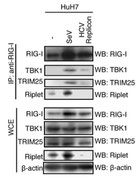
C型肝炎ウイルスに感染すると細胞内のRipletタンパク質が分解されて消えてしまいます。
(Oshiumi H et al PLoS Pathogens 2013)
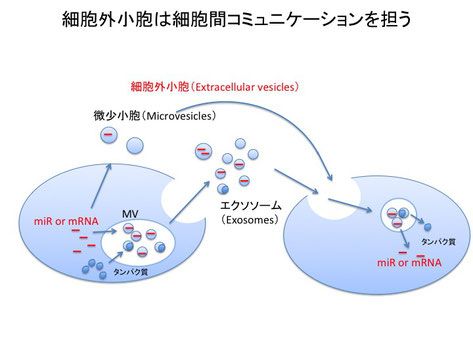
エクソソームと自然免疫
細胞から放出される小胞は細胞外小胞(Extracellular vesicles:EV)と呼ばれます。この細胞外小胞には、細胞の多胞体(Multivesicular body: MV)から放出されるエクソソームや、細胞膜から放出される微少小胞(Microvesicles)を含みます。エクソソームはmRNAやmicroRNAなどの機能的なRNAに加えて様々なタンパク質を含み、エクソソームがこれらのRNAやタンパク質を他の細胞へと伝達する役割を担うことがわかっています。また、最近の研究から、エクソソームだけでなく、微少小胞も同様の役割を担うことが明らかとなってきました。
正常な細胞から放出されるエクソソームと異なり、がん細胞から放出されるエクソソームは、がん細胞特異的なRNAやタンパク質を含むことから、エクソソームががん診断へと応用できる可能性が注目されています。私達の研究室では、ウイルスに感染した細胞から放出されるエクソソームに着目し研究をしたところ、ウイルス感染細胞から放出されるエクソソームに、ウイルス由来の成分が含まれることを発見しました。さらに、ウイルス感染細胞と非感染細胞から放出されるエクソソームを詳細に比較したところ、エクソソーム内の宿主の成分も大きく変化することを発見しました。
例えばヒトの肝がんの主要な原因となるB型肝炎ウイルスの場合、B型肝炎ウイルスに感染した肝細胞から放出されるエクソソームには、B型肝炎ウイルスのRNAが含まれることを発見しました。このエクソソーム内のウイルスRNAがマクロファージに認識されると、マクロファージは、NK細胞活性化受容体を発現し、NK細胞依存的なIFN-γの産生を誘導することを発見しました。また、ウイルス感染により大きく変化するエクソソーム内の宿主成分としてmiR-21とmiR-29aと呼ばれるmicroRNAを同定しました。このmiR-21とmiR-29aはマクロファージからのIL-12産生を抑制する働きをします。おそらくウイルスは、宿主の自然免疫を逃れるために、エクソソームの宿主成分を変化させ、ウイルスにとって有利な環境を築いていると思われます。詳しくはKouwaki T et al Frontiers in Immunologyの論文をご覧下さい。
熊本大学
大学院生命科学研究部
大学院医学教育部
医学部医学科
免疫学講座
〒860-8556
熊本市中央区本荘1−1−1
TEL : 096-373-5135(研究室)
FAX: 096-373-5138
Department of Immunology,
Graduate School of Medical Sciences,
Faculty of Life Sciences,
School of Medicine
Kumamoto University
1-1-1, Honjo, Chuo-ku, Kumamoto, 860-8556 Japan
Tel: +81-96-373-5135
Fax: +81-96-373-5138